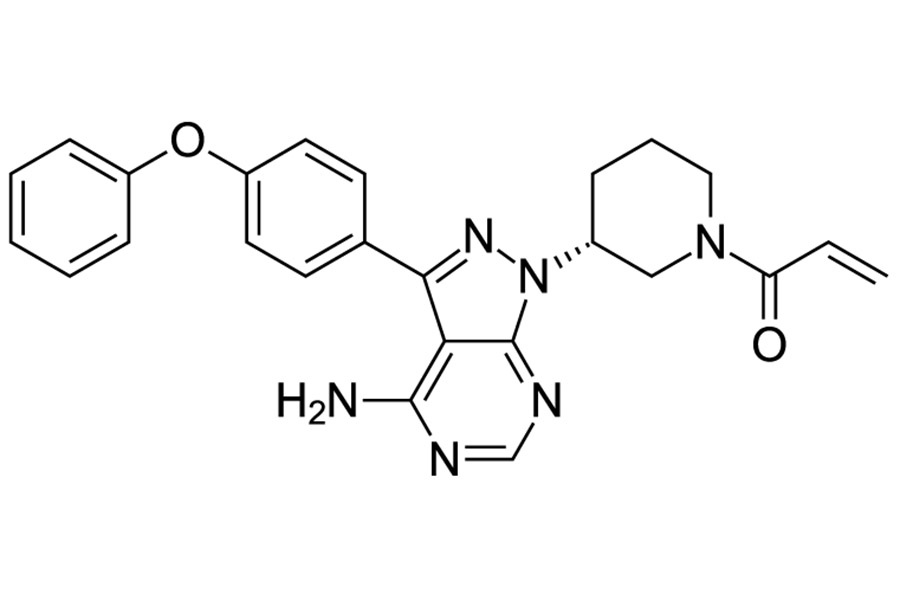
Ибрутиниб - это противоопухолевый препарат, который предназначен для лечения злокачественных B-лимфопролиферативных заболеваний. Средство представляет собой ковалентный селективный ингибитор тирозинкиназы Брутона, которая играет важную роль в поддержании жизнеспособности злокачественных клеток.
В ноябре 2013 года ибрутиниб был одобрен Управлением по контролю за продуктами и лекарствами США (FDA) для лечения мантийноклеточной лимфомы. В феврале 2014 года он был одобрен для лечения макроглобулинемии Вальденстрема в 2015 году.
В марте 2016 года в США было одобрено новое показание к применению ибрутиниба у пациентов с хроническим лимфолейкозом (ХЛЛ).
В мае 2016 года в Соединенных Штатах было одобрено новое показание к применению ибрутиниба при хроническом лимфолейкозе (ХЛЛ) и лимфоцитарной лимфоме малых размеров (SLL).
В январе 2017 года в Соединенных Штатах было одобрено новое показание к применению ибрутиниба для лечения взрослых с рецидивирующей / рефрактерной (R / R) лимфомой маргинальной зоны (MZL), которым требуется системная терапия и которые ранее получали по крайней мере одну терапию на основе анти-CD20.
В августе 2017 года FDA одобрило новое показание к применению ибрутиниба для лечения болезни "трансплантат против хозяина". Это был первый препарат, одобренный FDA для лечения этого заболевания.
В феврале 2018 года таблетированная форма ибрутиниба была одобрена для использования в США.
В августе 2018 года ибрутиниб в комбинации с ритуксимабом был одобрен в Соединенных Штатах для лечения взрослых с макроглобулинемией Вальденстрема (WM), редким и неизлечимым типом неходжкинской лимфомы (НХЛ).
В январе 2019 года ибрутиниб в комбинации с обинутузумабом был одобрен для лечения взрослых с ранее нелеченным хроническим лимфолейкозом / лимфоцитарной лимфомой малого размера (ХЛЛ /SLL).
В апреле 2020 года FDA расширило показания к применению ибрутиниба, включив его комбинацию с ритуксимабом для начального лечения взрослых с хроническим лимфолейкозом (ХЛЛ) или лимфоцитарной лимфомой малого размера (SLL). Одобрение было основано на исследовании E1912 (NCT02048813), рандомизированном, многоцентровом, открытом, активно контролируемом исследовании ибрутиниба в соотношении 2: 1 с ритуксимабом в сравнении с флударабином, циклофосфамидом и ритуксимабом (FCR) у 529 взрослых пациентов 70 лет и моложе с ранее нелеченным ХЛЛ или СЛЛ, требующим системной терапии.
В России Ибрутиниб зарегистрирован с февраля 2015 года. Это первое в своем роде пероральное лекарственное средство, показанное для терапии рецидивирующей или рефрактерной мантийноклеточной лимфомы (МКЛ). Также препарат показан для лечения взрослых пациентов с хроническим лимфоцитарным лейкозом (ХЛЛ), получавших до этого, по крайней мере, одну линию терапии. Кроме того, ибрутиниб может использоваться в качестве первой линии терапии у пациентов с ХЛЛ с делецией хромосомы 17p или мутацией гена TP53 при наличии противопоказаний к химиотерапии.
В ноябре 2013 года ибрутиниб был одобрен Управлением по контролю за продуктами и лекарствами США (FDA) для лечения мантийноклеточной лимфомы. В феврале 2014 года он был одобрен для лечения макроглобулинемии Вальденстрема в 2015 году.
В марте 2016 года в США было одобрено новое показание к применению ибрутиниба у пациентов с хроническим лимфолейкозом (ХЛЛ).
В мае 2016 года в Соединенных Штатах было одобрено новое показание к применению ибрутиниба при хроническом лимфолейкозе (ХЛЛ) и лимфоцитарной лимфоме малых размеров (SLL).
В январе 2017 года в Соединенных Штатах было одобрено новое показание к применению ибрутиниба для лечения взрослых с рецидивирующей / рефрактерной (R / R) лимфомой маргинальной зоны (MZL), которым требуется системная терапия и которые ранее получали по крайней мере одну терапию на основе анти-CD20.
В августе 2017 года FDA одобрило новое показание к применению ибрутиниба для лечения болезни "трансплантат против хозяина". Это был первый препарат, одобренный FDA для лечения этого заболевания.
В феврале 2018 года таблетированная форма ибрутиниба была одобрена для использования в США.
В августе 2018 года ибрутиниб в комбинации с ритуксимабом был одобрен в Соединенных Штатах для лечения взрослых с макроглобулинемией Вальденстрема (WM), редким и неизлечимым типом неходжкинской лимфомы (НХЛ).
В январе 2019 года ибрутиниб в комбинации с обинутузумабом был одобрен для лечения взрослых с ранее нелеченным хроническим лимфолейкозом / лимфоцитарной лимфомой малого размера (ХЛЛ /SLL).
В апреле 2020 года FDA расширило показания к применению ибрутиниба, включив его комбинацию с ритуксимабом для начального лечения взрослых с хроническим лимфолейкозом (ХЛЛ) или лимфоцитарной лимфомой малого размера (SLL). Одобрение было основано на исследовании E1912 (NCT02048813), рандомизированном, многоцентровом, открытом, активно контролируемом исследовании ибрутиниба в соотношении 2: 1 с ритуксимабом в сравнении с флударабином, циклофосфамидом и ритуксимабом (FCR) у 529 взрослых пациентов 70 лет и моложе с ранее нелеченным ХЛЛ или СЛЛ, требующим системной терапии.
В России Ибрутиниб зарегистрирован с февраля 2015 года. Это первое в своем роде пероральное лекарственное средство, показанное для терапии рецидивирующей или рефрактерной мантийноклеточной лимфомы (МКЛ). Также препарат показан для лечения взрослых пациентов с хроническим лимфоцитарным лейкозом (ХЛЛ), получавших до этого, по крайней мере, одну линию терапии. Кроме того, ибрутиниб может использоваться в качестве первой линии терапии у пациентов с ХЛЛ с делецией хромосомы 17p или мутацией гена TP53 при наличии противопоказаний к химиотерапии.